T1.10 Sepsis
Publisert: 25.10.2023
Bjørn Blomberg, Hans Flaatten, Steinar Skrede
Kort oppsummering
-
Definisjoner. Sepsis: Med sepsis forstås en livstruende organdysfunksjon utløst av en ubalansert vertsrespons på infeksjon, til skille fra infeksjon uten organsvikt. Septisk sjokk er infeksjon der sirkulasjonssvikt fører til avvik i celleresponser og metabolisme. Klinisk defineres sepsis som infeksjon, og en økning på ≥ 2 poeng i SOFA-skår brukes som indikasjon på organsvikt. Septisk sjokk defineres klinisk som sepsis med behov for vasopressor for å holde MAP (middelarterietrykk) > 65 mm Hg og der s-laktat fortsatt er > 2 mmol/l etter initial væskeresuscitering
Sepsis har ulike forløp og faser som avhenger av medfødte og ervervede vertsfaktorer (alder, immunstatus, kirurgi, medikamentell behandling) og mikrobefaktorer.
-
Diagnostikk. Sepsisdiagnosen stilles dersom pasienten har mistenkt eller bekreftet infeksjon (sykehistorie, klinisk, diagnostisk) og samtidig tegn på organdysfunksjon. Organdysfunksjon påvises og alvorlighetsgrad vurderes ved bruk av:
o SOFA-skår (Sequential Organ Failure Score), se T1 Tabell 7 SOFA* – definisjoner på akutt organdysfunksjon .
o quickSOFA (qSOFA) er et enkelt skåringssystem for å risikovurdere pasienter, der en skår på ≥ 2 av 3 positive tegn gir mistanke om organdysfunksjon og risiko for død > 10 %. Det har høy spesifisitet. qSOFA brukes ikke til å diagnostisere sepsis og skal ikke benyttes som eneste skårsystem ved mistenkt sepsis på grunn av svært lav sensitivitet,
1. En akutt endring i bevissthetsnivå
2. Systolisk BT ≤ 100 mm Hg
3. Respirasjonsfrekvens ≥ 22/minutt
Til risikovurdering og for etablering av plan for rett behandlingsnivå kan eksempelvis National Early Warning Score 2 (NEWS2) benyttes sammen med qSOFA.
Legemiddelbehandling. Hos pasienter med septisk sjokk eller sannsynlig sepsis startes antibiotikabehandling så snart som mulig og innen 1 time. Hos pasienter med mulig sepsis, men uten sjokk, kan man bruke inntil 3 timer på utredning før ev. oppstart av antibiotika. Antibiotikavalg er i henhold til Nasjonal faglig retningslinje for bruk av antibiotika i sykehus: standardbehandling ved ukjent fokus og etiologi: (I) benzylpenicillin i.v. 2,4 g × 6 og gentamicin i.v. 6–7 mg/kg × 1, alternativ behandling: (II) cefotaksim i.v. 2 g x 3 eller (III) piperacillin-tazobaktam i.v. 4/0,5 g x 4. Ved mistenkt anaerob infeksjon, f.eks. ved intraabdominal infeksjon, gis i tillegg til (I) eller (II): metronidazol i.v. 1,5 g x 1 ladningsdose, så i.v. 1 g x 1. Ved høy risiko for ESBL (extended-spectrum betalaktamase)-produserende bakterier, f.eks. ved infeksjon ervervet i sykehus i utlandet gis meropenem i.v. 1 g x 3. Ved septisk sjokk eller kritisk syk pasient (multiorgansvikt) er standardbehandling piperacillin-tazobaktam i.v. 4/0,5 g x 4, der første dose gis som ladningsdose over 30 min, og neste dose startes umiddelbart etter ladningsdosen. Denne og videre doser gis over 3 timer. Ved septisk sjokk og mistanke om ESBL-resistens gis meropenem i.v. 2 g x 3. Ladningsdose 1 g gis over 30 min. Neste dose startes umiddelbart etter ladningsdosen. Denne og videre doser gis over 3 timer. Antibiotikabehandling gis umiddelbart etter mikrobiologisk prøvetaking, der blodkulturer har høyeste prioritet. Antibiotikavalg avhenger av infeksjonsfokus. Der fokuset er påvist gis målrettet antibiotika. Vurder samtidig behov for sanering av infeksjonsfokus ved fjerning av katetere, andre fremmedlegemer, kirurgisk behandling, avlastning eller drenasje. Nasjonal faglig retningslinje angir situasjoner der aminoglykosider bør unngås eller behandlingsdoser justeres.
Organdysfunksjoner: Hypotensjon: Væskebehandling (mål: 30 ml/kg Ringer acetat i.l.a. de tre første timer). Vasoaktive legemidler dersom vedvarende sirkulasjonssvikt tross adekvat væskebehandling: Noradrenalin, startdose 0,05 μg/kg/minutt. Mål: systolisk BT > 90 mm Hg (MAP > 65 mm Hg), tilfredsstillende timediurese, normalisering av laktat. Annen farmakoterapi ved dårlig effekt av infeksjonsbehandling, oksygentilskudd, væskebehandling og vasoaktive legemidler: vasopressin og analoger. Blod og blodprodukter (SAG, plasma, trombocytter) ved indikasjon, spesielt ved akutt koagulopati. Insulin med glukose ved hyperglykemi (mål: blodglukose 6,1–10 mmol/l). Glukokortikoider ved vedvarende hypotensjon tross behandling med væske og vasopressor.
Generelt
Sepsis er infeksjonstilstander der pasienter blir allment påvirket og utvikler organdysfunksjon som følge av infeksjonen. Med septisk sjokk forstår man infeksjon der sirkulasjonssvikt fører til avvik i celleresponser og metabolisme.Formell sepsisdiagnose stilles ved å gradere organdysfunksjon etter SOFA skår (tabell), der SOFA skår på 2 eller mer, eller økning på 2 poeng eller mer fra habitualtilstanden, definerer sepsis (se T1 Tabell 7 SOFA* – definisjoner på akutt organdysfunksjon). Septisk sjokk defineres som hypotensjon som ikke responderer på væskebehandling med fortsatt serum laktat > 2 mmol/l, der det er behov for vasopressor for å holde middelarterietrykk > 65 mm Hg.
Man må vurdere infeksjonspasienten systematisk med tanke på organfunksjoner. Sepsis er sannsynlig dersom en pasient med infeksjon har hypotensjon, påvirket respirasjon, nedsatt bevissthet, oliguri, ikterus eller tegn til blødninger. Sepsis er vanlig og særlig høy forekomst er det blant de eldste pasientene. Demografiske forhold medfører at forekomsten er økende.
Alvorlighet av sepsis bestemmes av omfang og grad av organdysfunksjoner som hos kritisk syke pasienter i sin alminnelighet. Hvor raskt sykdommen utvikler seg avhenger bl.a. av pasientens alder, helsetilstand, immunstatus, infeksjonsfokus, mikrobiologisk etiologi, antimikrobiell resistens og av hvilke tiltak som er utført. Valg av antibiotika gjøres i henhold til Nasjonal retningslinje for bruk av antibiotika i sykehus og tar utgangspunkt i klinisk diagnose og miljøet infeksjonen primært er oppstått i. Eksempelvis er nosokomialt oppstått sepsis hyppig. For noen grupper er det sammenheng mellom tid til antibiotika og utfall. I en studie av subgruppen sepsis med hypotensjon og sjokk økte dødeligheten med omtrent 7 % for hver time forsinkelse i antibiotikabehandling. Ved sjokk eller ved ny organsvikt skal antibiotika gis innen en time. Ved mistenkt sepsis uten sjokk er det rom for begrenset utredning av infeksjon, og eventuell oppstart av antibiotika kan finne sted innen 3 timer etter innleggelse, eller etter mistanken er fattet under opphold i sykehus. Ved sepsis gis antibiotika intravenøst, i høye doser og spesielt for penicilliner, med ladningsdose og hyppig nok. Behandlingen må være tilstrekkelig bredspektret når infeksjonsfokuset og den mikrobielle etiologien er ukjent. Pasienter med sepsis og uttalt organsvikt må håndteres i avdeling med erfaring og utstyr til å behandle og overvåke kritisk syke med sviktende organfunksjoner.
Epidemiologi
Sepsis er hyppig, insidensen øker i takt med at befolkningen blir eldre og er nå omtrent 1,5 per 1000 per år (sepsis med organsvikt). Sykehusdødeligheten ved sepsis med organsvikt er ca. 15 %, men over 40 % ved septisk sjokk. På verdensbasis er det estimert nær 50 millioner årlige tilfeller med sepsis. Sepsis bidrar til mer enn 10 millioner dødsfall globalt, svarende til en femtedel av alle dødsfall.
Etiologi
Hos omtrent 3/4 av pasientene finner man primærfokuset klinisk ved første vurdering. De fleste tilfeller er samfunnservervet. Andelen oppstått i sykehus er høy, men tallfesting er upresis. Nedre luftveier er fokus hos omtrent 50 %, abdominalfokus er hyppigere i sykehus (omtrent 30%) enn samfunnservervet sepsis (10 %), mens urinveier og bløtvev står for omtrent 20 og 5 % hver. Det er sammenheng mellom pasientens alder og årsaker til bakteriell sepsis. Hos nyfødte i første uke etter fødselen er de viktigste årsakene gruppe B-streptokokker (Streptococcus agalactiae), gramnegative intestinale stavbakterier, og Listeria monocytogenes. I småbarns- og skolealderen dominerer pneumokokker (fallende etter innføring av pneumokokkvaksinasjon) og stafylokokker, også meningokokker forekommer. Hos pasienter eldre enn 65 år dominerer Enterobacterales, samt grampositive mikrober som stafylokokker, streptokokker, enterokokker og pneumokokker. Overvåkingsdata fra NORM (NORMVET 2022) gir nasjonal oversikt over resistensforhold hos mikrober fra kliniske isolat fra blodkulturer. Data derfra viser at i blodkultur utgjør E.coli den høyeste andelen (28%), for stafylokokker (14%) er den økende, mens den er fallende for pneumokokker (3,4%). Opportunistiske mikrober er fremdeles uvanlige, men av demografiske og medisinske grunner er forekomsten noe økende. Omtrent 1/3 av pasientene får påvist etiologisk agens i blodkultur, ytterligere 1/3 av tilfellene får etiologisk diagnose gjennom andre mikrobiologiske undersøkelser, mens agens ikke påvises hos den resterende 1/3. Det er økende resistens blant gramnegative mikrober, men 95 % av både E. coli- og Klebsiella-isolater fra blodkultur er fremdeles følsomme for aminoglykosider som gentamicin. ESBL-resistens, dvs. resistens mot både penicilliner og cefalosporiner forekommer i 6 % av E. coli- og 5% av Klebsiella-isolater fra blodkultur, mens resistens mot ciprofloksasin er nå falt til rundt 8-10 % i disse mikrobene. ESBL-produserende bakterier har ofte koblet resistens mot mange andre antibiotika, inkludert ciprofloksacin. Karbapenemer er tryggeste valg og anbefalt ved høy mistanke om ESBL-resistens. I Norge er det fremdeles bare sporadiske tilfeller av penicillinresistente pneumokokker, og 99 % av gule stafylokokker fra blodkulturer er følsomme for primærmidlet kloksacillin. Forekomsten av mikrober med problematiske resistensforhold er større ved infeksjoner oppstått i sykehus enn i samfunnet.
Diagnostikk
Diagnostikk og behandling av pasienter med sepsis er tverrfaglig og må gjennomføres hurtig. Diagnosen stilles klinisk, se T1 Tabell 6 Definisjoner, sepsis. Organsvikt vurderes vha SOFA-skår, mens qSOFA kun er en screening på tre organfunksjoner og skal ikke brukes som eneste skårsystem ved mistenkt sepsis, se T1 Tabell 7 SOFA* – definisjoner på akutt organdysfunksjon. Den reviderte definisjonen av septisk sjokk er:
• MAP < 65 mm Hg til tross for bruk av vasopressor og
• Vedvarende laktatverdier > 2 mmol/l til tross for adekvat væskeresuscitering
Det tas prøver til biokjemiske undersøkelser, se T1 Tabell 8 Aktuelle biokjemiske markører for inflammasjon og organdysfunksjon ved sepsis. Mikrobiologisk diagnostikk er svært viktig og tilstrebes gjennomført før start av antimikrobiell behandling, men kan også være aktuelt også ut i sykdomsforløpet, se T1 Tabell 9 Aktuelle mikrobiologiske prøver ved sepsis. Bildediagnostikk gjennomføres i henhold til klinisk indikasjon.
Behandling
Behandling av sepsis har som mål å sanere tilgrunnliggende infeksjon, bevare organfunksjon, opprettholde vevsoksygenering og unngå komplikasjoner. Dødeligheten av sepsis, og særlig septisk sjokk, øker raskt ved forsinkelser i behandling med antibiotika, sanering av infeksjonsfokus eller væske- og støttebehandling. Fordi tilstanden kan forverres raskt må pasientene følges nøye.
-
Behandling av infeksjon. Empirisk valg av antibiotika ved alvorlig sepsis med ukjent utgangspunkt og etiologi er anført i T1 Tabell 10 Initiale valg og dosering av antibiotika ved sepsis med ukjent utgangspunkt og etiologi. Ved kritisk syk pasient med septisk sjokk / flerorgansvikt, er det aktuelt å vurdere bredspektret behandling som piperacillin-tazobaktam eller karbapenemer fra starten. Karbapenemer er primærvalg i mange land, men i Norge benyttes midlene først og fremst ved høy mistanke om ESBL-resistent mikrobe, ved gjennombruddsinfeksjon i sykehus, eller ved antatt terapisvikt. Det er økt risiko for infeksjoner forårsaket av ESBL-produserende bakterier dersom pasienten har hatt kjent kolonisering eller infeksjoner med ESBL-produserende bakterier siste året, har mottatt bredspektret antibiotikabehandling nylig, har hatt langvarig sykehusopphold eller omfattende abdominal kirurgi, har vært innlagt i sykehus utenfor Norden eller reist i land med høy ESBL-forekomst. I tillegg må lokale resistensforhold vektlegges.
Ved sepsis er norsk tradisjon å gi kombinasjonsbehandling med et smalspektret penicillin og aminoglykosid, ev. med tillegg av metronidazol ved mistenkt anaerob infeksjon. Dette er opprettholdt som standardbehandling i nasjonale retningslinjer for antibiotikabruk i sykehus, revidert i desember 2022. Aminoglykosider er nefrotoksiske og bruken av dem må veies opp mot risikoen den enkelte pasienten har for utvikling av akutt nyresvikt. De bør ikke brukes om det allerede foreligger tegn på nyresvikt. Aminoglykosidenes viktigste egenskap er hurtig baktericid virkning, særlig i blodbanen. Hos mange pasienter kan kort behandlingstid med disse midlene være aktuelt, med overgang til andre midler senere. Jo kortere behandlingstid med aminoglykosider, desto mindre risiko for nyreskade.
Når bakteriologisk diagnose foreligger, ev. med resultat av resistensundersøkelse, kan kombinasjonsbehandling ofte erstattes av mer spesifikk behandling. Noen vertsavhengige og mikrobeavhengige situasjoner forutsetter bredspektret antibiotikabehandling, inkludert kombinasjonsbehandling eller særlige valg. Pasienter der antibiotikabehandling pågår eller nylig er avsluttet bør motta middel fra annen antibiotikagruppe. Stafylokokkdekning overveies for pasienter med intravenøst rusmisbruk, tidlige implantatinfeksjoner, ved bruk av langtidskatetre og hemodialyse. Det er aktuelt å justere behandling ved bærerskap med resistent mikrobe, slik som MRSA. Ved nosokomial sepsis kan mindre virulente mikrober med problematisk resistens være aktuelle, slik som enterokokker, koagulasenegative stafylokokker, Pseudomonas, Serratia, Acinetobacter og Candida. Kontakt med spesialist i infeksjonssykdommer anbefales. I Norge er det økende forekomst av antibiotikaresistente bakterier, selv om situasjonen fremdeles er gunstigere enn globalt. ESBL-produserende mikrober som også er resistente for karbapenemer, er sjelden i Norge. For empirisk valg i denne siste situasjonen henvises til spesiallitteratur. Ved mistanke om sepsis og mistanke om MRSE (hvite stafylokokker) eller MRSA anbefales tillegg av vankomycin.
Behandlingsvarigheten avgjøres på bakgrunn av en rekke faktorer og varierer fra en til flere uker. Rask identifikasjon og sanering av infeksjonsfokus bedrer overlevelsen. Mistenker man at fremmedlegemer som katetre er infiserte, må disse fjernes.
-
Behandling av organdysfunksjoner. Alle med sepsis har en grad av organsvikt i henhold til reviderte definisjoner. Graden av organsvikt og antall sviktende organer er avgjørende for prognosen. De vanligste organdysfunksjoner er sirkulasjonssvikt (synonymt septisk sjokk) og respirasjonssvikt. Sepsis er også den hyppigste årsaken til både akutt nyresvikt og disseminert intravaskulær koagulasjon. Akutt organsvikt/dysfunksjon baserer seg nå på bruk av SOFA-skår som vurderer seks vitale organfunksjoner.
Handlingsskjema for initialbehandling av sepsis
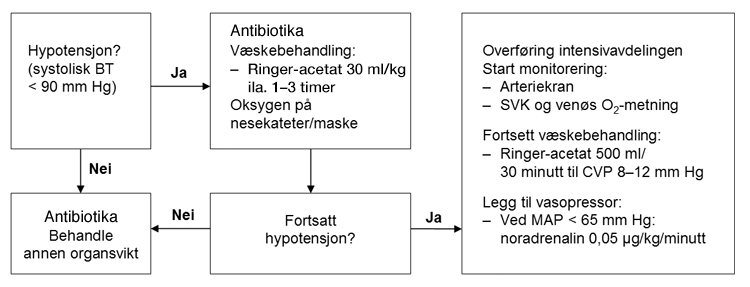
-
Akutt sirkulasjonssvikt (septisk sjokk): Hypotensjon ved sepsis skyldes en relativ hypovolemi som følge av vasodilatasjon med økt blodstrøm i huden og ekstravasering av væske pga. kapillærlekkasje. Hjertets minuttvolum (CO) økes som regel kompensatorisk, men kan falle pga. toksisk påvirkning. Pasientene er ofte mentalt påvirket (forvirring). Septisk sjokk defineres som hypotensjon (MAP < 65 mm Hg) som ikke lar seg korrigere med væskebehandling alene, men trenger vasoaktiv behandling, der serum laktat er > 2 mmol/l.
Væskebehandling: Førstelinje i behandlingen er intravenøs tilførsel av væske i form av krystalloider (se T23 Septisk sjokk (og andre distributive sjokk)), vanligvis Ringer-acetat. Målet er Ringer-acetat 30 ml/kg i løpet av de første 1–3 timer (avhengig av klinisk respons). Albumin kan vurderes hvis behovet for væske er stort. Hydroksyetylstivelse (HES) er kontraindisert pga. økt mortalitet og nyresvikt.
Vasoaktive legemidler: Dersom vedvarende sirkulasjonssvikt tross adekvat væskebehandling, gis behandling med vasoaktive legemidler. Bruken av disse bør styres etter kontinuerlig måling av arterietrykk (intraarteriell BT-måling), ev. også etter måling av hjertets minuttvolum (CO). Noradrenalin motvirker kardilatasjon, dobutamin øker hjertets minuttvolum, mens dopamin har begge effektene avhengig av dosering. Ved bruk av dobutamin bør CO monitoreres. Noradrenalin er førstevalg, da bruk av dopamin synes å være forbundet med flere komplikasjoner og økt mortalitet. Noradrenalin er uegnet ved svært enteralt væsketap da fokus for behandlingen her er aggressiv væskebehandling med krystalloider til volumstatus er gjenopprettet. Alle vasoaktive legemidler bør gis i sentralt venekateter. En enkel oversikt over effekt av ulike vasoaktive legemidler er vist i T1 Tabell 11 Vasoaktive legemidler . Målet for behandlingen er systolisk BT > 90 mm Hg (MAP > 65 mm Hg), tilfredsstillende organperfusjon (timediuresemåling) og rask normalisering av laktat (< 2 mmol/l).
Blod og blodprodukter: Erytrocyttkonsentrat ved Hb < 7 g/100 ml, med målsetting 7–9 g/100 ml, med høyere verdier spesielt hos eldre. Bruk av plasma kan også være aktuelt ved koagulopati og blødning og ved spesielt store behov for væske, men da som tillegg til krystalloider (se T23 Bruk av blod og blodprodukter). Blodplater gis ved alvorlig trombocytopeni (< 10·109/l), ved blødningsrisiko og moderat trombocytopeni (< 20·109/l) eller ved blødning eller behov for akutt kirurgi ved verdier < 50·109/l.
Annen farmakoterapi: Vurderes hos pasienter med sepsis med dårlig effekt av initial behandling (infeksjonsbehandling, oksygentilskudd, væskebehandling og vasoaktive legemidler).
Vasopressin (opp til 0,04 E/minutt, el. 2,4 E/time) og analoger har vist seg effektive ved refraktære sjokk, der effekten av alfaadrenerge agonister er utilstrekkelig.
Insulin anbefales ved blodsukker > 10 mmol/l, med målsetting 6,1–10 mmol/l Det er behov for hyppig blodsukkerkontroll i denne fasen.
Glukokortikoider (Solu-Cortef 50 mg i.v x 4) kan gis ved vedvarende hypotensjon tross behandling med væske og vasopressor. Det skal ikke brukes rutinemessig ved septisk sjokk, da dette ikke gir terapeutisk gevinst. Glukokortikoider benyttes fortrinnsvis i tidlige faser av sepsis. Doser > 300 mg/døgn frarådes. ACTH stimuleringstest anbefales ikke rutinemessig.
Normalt humant immunglobulin til intravenøst bruk (IVIG) har ikke dokumentert effekt på overlevelse ved sepsis generelt, men er anbefalt ved septisk sjokk forårsaket av Streptococcus pyogenes (gruppe A streptokokker). Det vises til Nasjonal faglig retningslinje for antibiotika i sykehus og spesiallitteratur.
Akutt respirasjonssvikt. Akutt hypoksisk respirasjonssvikt (type 1) kjennetegnes av takypné (respirasjonsfrekvens > 20) og hypoksemi (pO2(a) < 8 kPa eller sO2(a) < 90 % i romluft, eller pO2(a)/FiO2 < 53,3 kPa). Respirasjonssvikt graderes etter SOFA-skår. Mild respirasjonssvikt behandles med oksygen (2–10 l/min) på nesekateter eller maske, eventuelt høy flow nasal oksygen . Ved mer uttalt respirasjonssvikt brukes ventilasjonsstøtte med CPAP (kontinuerlig positivt luftveistrykk, anbefalt innstilling ved oppstart: 5 cm H2O mottrykk og FiO2(I) 0,5). Dersom pasienten blir trett/utslitt eller stiger i respirasjonsfrekvens, pCO2(a) eller laktat, vurder BiPAP eller intubering og konvensjonell respiratorbehandling. Målet er pO2(a) > 9 kPa og sO2(a) > 90 %.
Akutt nyresvikt. Nyresvikt kan inntre tidlig under sepsis og kjennetegnes av lav timediurese (< 0,5 ml/kg/t) til tross for adekvat væskebehandling og bruk av vasoaktive legemidler, samt med økning i s-kreatinin og graderes etter SOFA-skår (fra kreatinin > 110 µmol/l og diurese < 500 ml/døgn). Pasienter med sepsis skal ha urinkateter for monitorering av timediurese. Haste-indikasjoner for oppstart av nyreerstattende behandling (T23 Dialyse og filtrasjon) er hyperkalemi (s-kalium > 6 mmol/l), økende metabolsk acidose (pH < 7,15) eller lungeødem pga. akutt overhydrering. All behandling og diagnostikk som medfører risiko for ytterligere nyreskade (kontrastmidler, aminoglykosider, Hydroksyetyl stivelse (HES) vurderes kritisk.
Akutt koagulopati. Ved akutt disseminert intravaskulær koagulasjon (DIC) ses foruten trombopeni også lave nivåer (forbruk) av fibrinogen, samt forhøyet D-dimer, INR (> 1,5) og aPTT (> 60). Sepsis er viktigste årsak til akutt DIC. Kliniske tegn er petekkier, ekkymoser, hudblødninger, samt sivblødning fra slimhinner, etter prøvetaking og ved anleggelse av venekanyle. Behandlingen er tilførsel av koagulasjonsfaktorer og trombocytter.
-
Legemiddelomtaler og preparater
Aktuelle nettressurser
Kilder
NORM-VET 2022 – Usage of antimicrobial agents and occurence of antimicrobial resistance in Norway
Evans L, Rhodes A, Alhazzani W, et al. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock 2021. Crit Care Med 2021 Vol. 49 Issue 11 Pages e1063-e1143
Karlsen E et al. Skåringsverktøy for tidlig oppdagelse av sepsis på sengepost. Tidsskr Nor Lægeforening, 2023
Kumar A, Roberts D, Wood KE, Light B, Parrillo JE, et al: Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock. Crit Care Med 2006;34:1589-1596
Rudd KE, Johnson SC, Agesa KM et al. Global, regional, and national sepsis incidence and mortality, 1990-2017: analysis for the Global Burden of Disease Study. Lancet 2020 Vol. 395 Issue 10219 Pages 200-211
Singer M, Deutschman CS, Seymour CW et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 2016; 315: 801-10
Svenska infektionsläkarföreningen. Vårdprogram. Sepsis och septisk chock.