G3.1 Nedsatt nyrefunksjon
Publisert: 08.11.2021
Sist endret: 07.02.2022
Generelt
Nedsatt nyrefunksjon (nyresvikt) medfører betydelige forandringer både i nyrenes ekskretoriske funksjon og sekundært i resten av kroppen. Dette gir endringer i farmakokinetikk og -dynamikk og krever dosejustering for mange legemidler. Legemidler kan også utløse eller forverre nyresvikt og kan forsterke symptomer som følge av svikten. Nyresvikt kan utvikles gradvis hos pasienter etter årelang vedlikeholdsbehandling (f.eks. nedsatt nyrefunksjon med økende alder). Mange pasienter er asymptomatiske, selv ved betydelig redusert nyrefunksjon.
Med nyrefunksjon menes i praksis glomerulær filtrasjonsrate (GFR), som tilsvarer summen av plasmafiltrasjonen som foregår i alle fungerende nefroner. Forventet GFR hos en nyrefrisk person avhenger blant annet av kroppsstørrelse. Derfor normaliseres GFR til en standardisert kroppsoverflate (1,73 m2) for gradering av nedsatt nyrefunksjon i klinisk sammenheng. Graden av nedsatt nyrefunksjon får ulike konsekvenser for dosering av legemidler som utskilles renalt. Gradering av nyrefunksjon ved kronisk nyresykdom gjøres etter følgende inndeling:
Stadium |
Nyrefunksjon |
GFR (mL/min/1,73m2) |
|---|---|---|
G1 |
Normal eller høy GFR |
≥ 90 |
G2 |
Lett nedsatt GFR |
60 - 89 |
G3a |
Lett til moderat nedsatt GFR |
45 - 59 |
G3b |
Moderat til betydelig (alvorlig) nedsatt GFR |
30 - 44 |
G4 |
Betydelig (alvorlig) nedsatt GFR |
15 - 29 |
G5 |
Endestadium (terminal) nyresvikt |
<15 |
Mål på nyrefunksjon
GFR kan måles nøyaktig ved hjelp av invasive og tidkrevende metoder hvor man måler clearance av en eksogen filtrasjonsmarkør (f.eks. inulin, joheksol eller EDTA). Dette er indisert i visse tilfeller, som for eksempel ved:
Behandling med cytostatika, svært toksiske medikamenter med smalt terapeutisk vindu eller der små endringer i GFR har stor betydning for dosering
Bekreftelse av nyresykdom/GFR-fall hvor et nøyaktig mål ønskes
Transplantasjonsvurdering av donor eller resipient
Oftest er estimering av GFR ved hjelp av endogene filtrasjonsmarkører tilstrekkelig for vurdering av nyrefunksjon, gitt at nyrefunksjonen er stabilisert. Serumkonsentrasjon av kreatinin er et relativt grovt mål på nyrefunksjon og gjenspeiler ved stabil nyrefunksjon balansen mellom tilførsel (muskelmasse og matinntak) og renal utskillelse, hovedsakelig ved glomerulær filtrasjon (GFR). Tubulær sekresjon av kreatinin bidrar normalt med 7-10% av kreatininutskillelsen i urin, men denne andelen øker ved fallende nyrefunksjon. Enkelte legemidler hemmer tubulær sekresjon av kreatinin (f.eks. cimetidin og trimetoprim).
Kreatininclearance (ClKr) er et mye brukt estimat på GFR og kan bestemmes ved å måle kreatininutskillelse i urin (samlet i kjent tidsrom) sammenholdt med serum-kreatinin på samme tid. ClKr gir noe høyere verdi enn reell GFR, og overestimeringen øker ved økende nyresvikt pga. økende tubulær sekresjon av kreatinin. Benevningen for ClKr er mL/min og er ikke standardisert til kroppsoverflate. ClKr gir generelt ikke et bedre mål på GFR enn estimert GFR basert på serumkonsentrasjon av kreatinin alene (se senere), men kan være nyttig hos enkelte pasienter. ClKr er fortsatt oppgitt som grunnlag for vurdering av dosejustering i mange preparatomtaler.
Kreatininclearance kan også beregnes ved hjelp av Cockcroft-Gault-formelen, som er benyttet i mange tidligere legemiddelstudier:
For kvinner reduseres den beregnede verdi med 15 %.
Formelen er ikke tilpasset de standardiserte kreatinin-metodene som benyttes i dag og vil overestimere reell ClKr med risiko for anbefaling av høyere legemiddeldosering enn det som var ment i de opprinnelige studiene.
Estimert GFR (eGFR) utgis automatisk av laboratoriet hos alle voksne pasienter når s-kreatinin rekvireres. Formlene som ligger til grunn for estimatet er godt validert mot målt GFR, og treffer innenfor 70 til 130% av målt GFR for ca. 85% av estimatene. I beregningen av eGFR inngår s-kreatinin, alder, kjønn og eventuelt rase. Estimert GFR utgis med benevningen mL/min/1,73m2. Tidligere ble MDRD-formelen benyttet, men nå anbefales det å bruke CKD-EPI kreatinin-formelen fordi denne har vist seg å være mer nøyaktig, spesielt hos pasienter med GFR > 60 mL/min/1,73 m2.
Det er kjent at kreatininbasert eGFR gir mer usikre estimater på nyrefunksjon hos pasienter med bl.a.:
avvikende muskelmasse i forhold til kjønn og alder (pasienter med lav BMI, muskelsykdommer, amputasjoner, lammelser og hos kroppsbyggere)
høyt inntak av kjøtt eller inntak av kreatin (kosttilskudd)
inntak av medikamenter som påvirker sekresjonen av kreatinin i nyrene (bl.a. cimetidin, trimetoprim)
I slike situasjoner kan eGFR basert på s-cystatin C være aktuelt. Cystatin C er et lite protein som filtreres fritt i glomeruli for deretter å reabsorberes og degraderes i nyretubuli. Produksjonen av cystatin C påvirkes ikke av muskelmasse, men derimot av steroidbehandling, hyper- og hypotyreose. Internasjonale anbefalinger er at laboratoriet automatisk oppgir en beregnet eGFR verdi i tillegg til serumkonsentrasjonen når man rekvirerer cystatin C. Det finnes ulike etablerte formler for estimering av GFR basert på cystatin C, hvorav CKD-EPI cystatin C er den mest anvendte og utprøvde formelen ved estimering av GFR basert på cystatin C i internasjonal litteratur.
Dersom det er stor diskrepans mellom eGFR basert på kreatinin og eGFR basert på cystatin C bør man etter en klinisk vurdering bruke det estimatet som er best egnet. Begge markørene har sine feilkilder.
Hvilket nyrefunksjonsmål bør man benytte til dosejustering hos voksne?:
Selv om CKD-EPI kreatinin-formelen er mer nøyaktig enn ClKr (estimert ved Cockcroft –Gault) til å estimere målt GFR, er det flere hensyn å ta i vurderingen av behov for dosejustering. Renal eliminasjon av legemidler avhenger av absolutt GFR (mL/min). Ved bruk av CKD-EPI-formelen som gir resultat med benevningen mL/min/1,73 m2, kan det være hensiktsmessig å regne om til absolutt GFR ved å ta hensyn til pasientens kroppsoverflate (absolutt GFR (mL/min) = GFR (mL/min/1,73 m2) x (kroppsoverflate (m2)/1,73)). Dette gjelder spesielt hvis pasienten har avvikende kroppsoverflate (er spesielt stor eller liten). Svært mange preparatomtaler oppgir ClKr som utgangspunkt for anbefalt dosejustering ved redusert nyrefunksjon, og man vil kunne observere store individuelle forskjeller mellom absolutt GFR (mL/min) estimert fra CKD-EPI kreatinin-formelen, og ClKr (mL/min) estimert fra Cockcroft-Gault-formelen. Spesielt har alder og vekt stor påvirkning. Om man skal holde seg til beregningen som gir mest korrekt estimat av reell GFR eller den som er oppgitt i preparatomtalen av medikamentet (til tross for at forutsetningene kan være endret etter utprøvingen) er ikke gitt i alle situasjoner. En mulig tilnærming er å gjøre beregninger av nyrefunksjon etter flere metoder og, dersom resultatene blir svært ulike, gjøre en avveining av risiko forbundet med over- og underdosering. Alternativt bør man måle GFR dersom det er indisert.
Farmakokinetiske forandringer
Renal ekskresjon av legemidler avtar parallelt med avtagende glomerulusfiltrasjon. For legemidler som utskilles vesentlig uforandret via nyrene (f.eks. benzylpenicillin, aminoglykosider, digoksin, litium), er det derfor god korrelasjon mellom totalclearance av legemiddel (kroppens totale eliminasjonsevne) og GFR. Legemidlers totalclearance påvirkes vanligvis i avtagende grad av nyresvikt ved økende andel metabolisme i lever. Hvis metabolisme i lever fører til dannelse av aktive metabolitter som skilles ut ved renal ekskresjon, kan nyresvikt medføre økt effekt og forlenget virkning. Utskillelsen av den aktive morfinmetabolitten morfin-6-glukuronid er således redusert ved nyresvikt, og effekten av morfin betydelig forlenget, selv om omdannelsen av morfin selv (i lever) er normal. Tilsvarende er påvist for midazolam og alfa-OH-midazolamglukuronid som har mindre effekt enn midazolam, men opphopes i betydelig grad under flere dagers administrering ved nyresvikt. Bivirkninger og toksiske effekter kan derved inntreffe.
Redusert plasmaproteinbinding ved uremi er påvist for flere sure og nøytrale legemidler som bindes til albumin. Opphopning av lipofile endogene stoffskifteprodukter, metabolsk acidose og nedsatt plasmakonsentrasjon av albumin bidrar til dette. Dette kan føre til feilbedømming av målt serumkonsentrasjon i forhold til angitt terapeutisk område for legemidler som til vanlig har høy grad av albuminbinding. Viktige eksempler er fenytoin, valproat og digitoksin. Ved måling av serumkonsentrasjon er det totalkonsentrasjonen (fritt + bundet) som måles. Ved endringer i proteinbindingsgrad må det derfor ved fortolkning av målt serumkonsentrasjon tas hensyn til forandring i proteinbinding. Det finnes nettbaserte kalkulatorer for beregning av «effektiv» fenytoinkonsentrasjon, justert for albuminnivå og grad av nyresvikt. Enkelte laboratorier tilbyr også analyse av fritt fenytoin og fritt valproat, som vil gi det mest nøyaktige målet på pasientens reelle medikamentbelastning.
Biotilgjengeligheten av ulike legemidler, spesielt vannløselige som antibiotika og furosemid, kan også forandres pga. gastrointestinale forstyrrelser som følge av uremi. Lipidløselige legemidler affiseres ikke eller lite av dette
Legemiddelindusert reduksjon i nyrefunksjon
Flere legemidler kan utløse eller forverre nyresvikt. Samtlige klassiske NSAID og koksiber (COX-2-hemmere) samt ACE-hemmere og angiotensin II-reseptorantagonister kan redusere nyrefunksjonen reversibelt ved å redusere nyreblodstrøm og filtrasjonstrykk. Risikofaktorer for legemiddelutløst akutt nyresvikt inkluderer høy alder, preeksisterende nyresvikt, diabetes mellitus, hypotensjon/hypovolemi/dehydrering, hjertesvikt og nyrearteriestenose. Aminoglykosider kan gi toksisk (tubulær) nyreskade. Røntgenkontrastmidler kan gi forverring av nyreskade. Risikoen er doserelatert og er særlig stor ved diabetes og ved væskeunderskudd. Ciklosporin er nyretoksisk og kan gi interstitiell betennelse og fibroseutvikling samt nedsatt nyrefunksjon. Litium over terapeutisk nivå kan gi polyuri, natrium- og væskeunderskudd og redusert litiumclearance med økende serumnivå og toksisitet. En lang rekke legemidler kan gi allergisk betinget nyreskade av glomerulær eller interstitiell type.
Legemiddelindusert forverring av uremisymptomer
Legemidler kan forsterke eller utløse symptomer på uremi, slik som polynevropati, kvalme og kløe. Kaliumsparende diuretika (amilorid, spironolakton, eplerenon), kaliumpreparater, ACE-hemmere og angiotensin II-reseptorantagonister kan utløse eller forverre hyperkalemi. Kombinasjon av flere av de nevnte midlene øker risikoen. Betareseptorantagonister og NSAID/koksiber kan også medvirke til økt serum-kalium, særlig i kombinasjon med de forannevnte.
Generelle kjøreregler ved legemiddelbehandling hos nyresviktpasienter
Man bør være kritisk ved vurdering av behandlingsindikasjon. Det bør velges legemiddel med minst mulig avhengighet av og påvirkning av nyrefunksjon, og helst et middel som hovedsakelig elimineres ved metabolisme til inaktive metabolitter. Så vidt mulig bør nevrotoksiske legemidler unngås.
Doseringsregler
Behovet for dosejustering ved nyresvikt avhenger av hvor stor andel av eliminasjonen som foregår ved renal utskillelse, men også av legemidlets terapeutiske bredde. Legemidler med smalt terapeutisk vindu som i stor grad utskilles uendret via nyrene, slik som litium og digoksin, kan være viktig å dosejustere selv ved lett redusert nyrefunksjon.
Normal metningsdose (startdose) bør vanligvis gis. Det er spesielt viktig å ikke redusere startdosen hvis terapeutisk effekt må oppnås raskt (f.eks. aminoglykosider ved alvorlige infeksjoner).
Vedlikeholdsdose må tilpasses totalclearance, og for legemidler med kun renal eliminasjon må vedlikeholdsdosen (døgndosen) reduseres tilsvarende reduksjonen i nyrefunksjon. Den reduserte døgndosen kan gis enten som reduserte enkeltdoser med normalt tidsintervall (f.eks. ved ønske om jevnere serumkonsentrasjon og der topper kan gi bivirkninger) eller som normale enkeltdoser med forlenget intervall (f.eks. ved behandling med antibiotika der konsentrasjonstoppene ofte er fordelaktige). Effekten av å gi redusert dosestørrelse sammenlignet med økt doseintervall er vist i figur 1. Kombinasjon av metodene kan også benyttes.
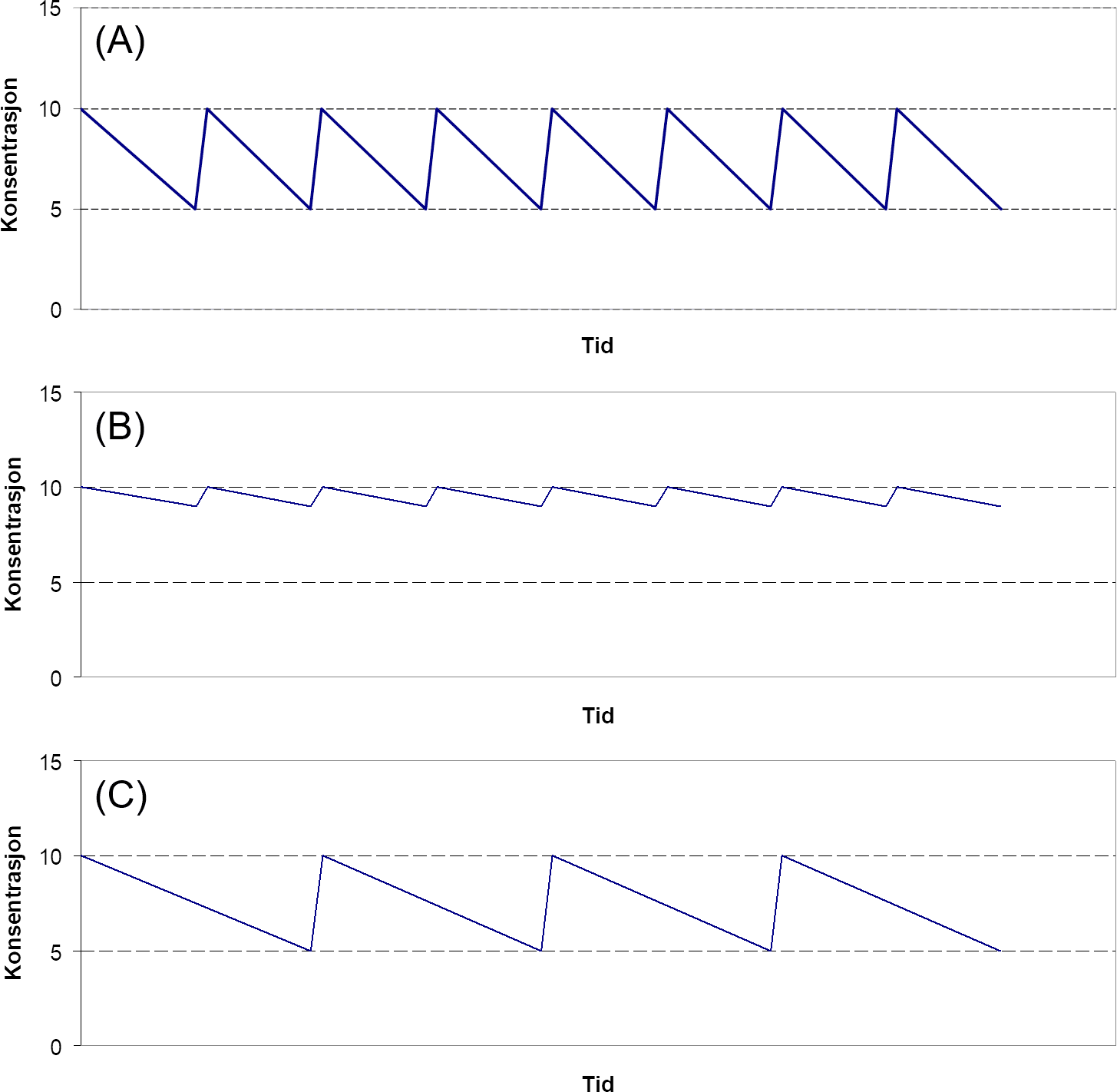
Figur 1. Prinsippskisser for tids-konsentrasjonskurver ved konsentrasjonslikevekt ved normal nyrefunksjon og dosering (A), ved nedsatt nyrefunksjon med redusert dosestørrelse (B), og ved nedsatt nyrefunksjon med økt doseintervall (C).
Vedlikeholdsdosen ved nyresvikt kan beregnes ut fra nomogrammer (formler) og uttrykkes som prosent av normaldosering. Eksempel på et slikt nomogram ses i figur 2. Figuren er ment som en illustrasjon av sammenhengen mellom nyrefunksjon, grad av renal eliminasjon og dosebehov. Konkret dosetilpasning bør gjøres ut fra anbefalinger for det enkelte legemiddel.
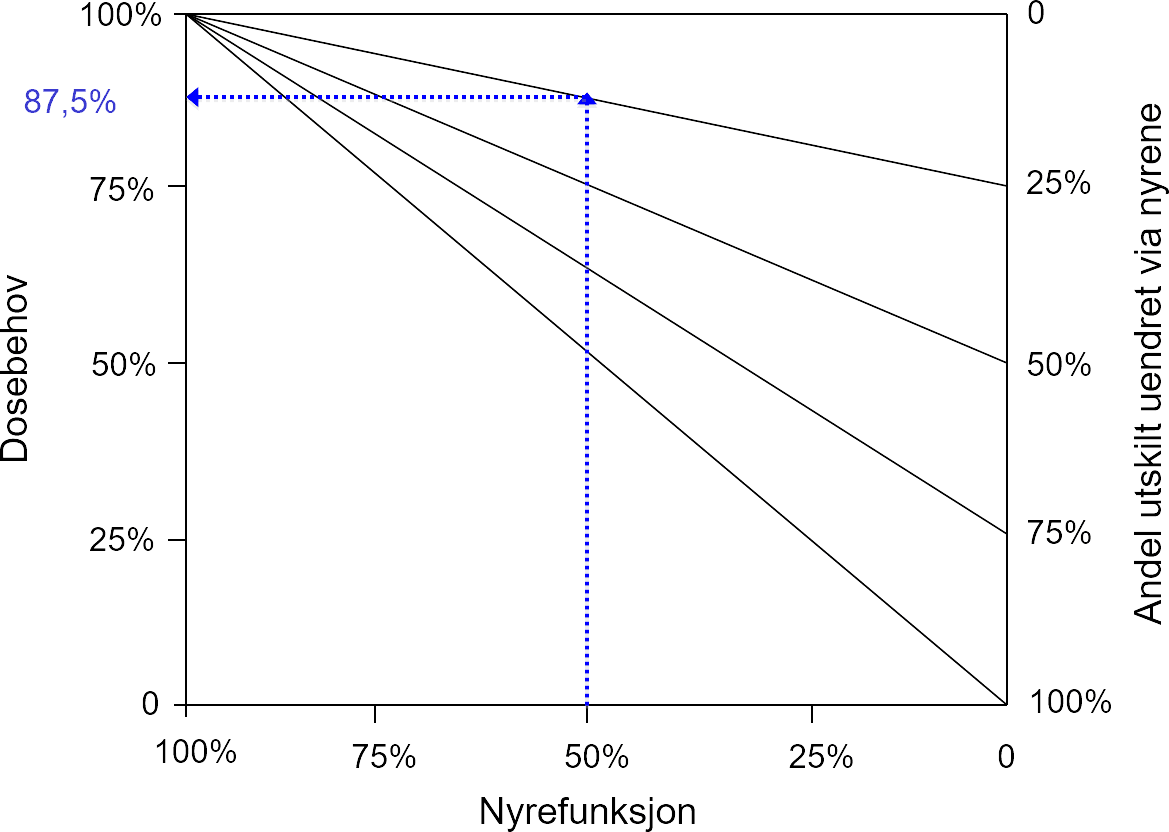
Figur 2. Nomogram for beregning av dosebehov. I dette eksempelet er nyrefunksjonen 50 % av normal funksjon (X-aksen), og 25 % av legemiddeldosen skilles ut uendret via nyrene (høyre akse). Dosebehovet leses av til 87,5% på venstre akse.
Ved akutt nyreskade eller fluktuerende nyrefunksjon (f.eks. sepsis, ustabil hemodynamikk i postinfarktfasen) og for potensielt toksiske legemidler med liten terapeutisk bredde (f.eks. aminoglykosider, digoksin) må dosejustering om mulig styres ved hjelp av hyppige serumkonsentrasjonsmålinger av legemidlet og omhyggelig klinisk kontroll.
Generelle beregningsmetoder og nomogrammer har åpenbare svakheter, inkludert faren for regnefeil. For legemidler hvor det foreligger velbegrunnede anbefalinger for gradert dosering ved nyresvikt, bør disse følges direkte. Stram behandlingsindikasjon og nøye seleksjon av legemiddel er spesielt viktig ved akutt og fluktuerende nyresvikt.
Ekstra dosetilskudd bør vurderes hos pasienter på intermitterende dialysebehandling dersom legemidlet er dialyserbart, eller hos pasienter som taper proteinbundne legemidler (f.eks. digitoksin) ved proteintap i urinen.
Se G3.2 Tabell G3 Tabell: Dosering ved nedsatt nyrefunksjon (alfabetisk).
Nasjonale retningslinjer
Helsedirektoratet (2016). Måling av estimert GFR (eGFR) og bruk av riktig formel [nettdokument]. Oslo: Helsedirektoratet (sist faglig oppdatert 20. desember 2019, lest 10. august 2021).
Helsedirektoratet (2021). Antibiotika i sykehus. [nettdokument]. Oslo: Helsedirektoratet (sist faglig oppdatert 5. oktober 2021, lest 10. oktober 2021).